الفرق الرئيسي بين النترات والنتريت هو أن النترات تحتوي على ثلاث ذرات الأكسجين المرتبطة بذرة النيتروجين في حين أن النيتريت يحتوي على ذرات الأكسجين المرتبطة بذرة النيتروجين.
كل من النترات والنتريت من الأنيونات غير العضوية التي تتكون من ذرات النيتروجين والأكسجين. كل من هذه الأنيونات لها شحنة كهربائية -1. تحدث بشكل أساسي كما أنيون مركبات الملح. هناك بعض الاختلافات بين النترات والنتريت. سنناقش تلك الاختلافات في هذه المقالة.
ما هو النترات؟
النترات هو أنيون غير عضوي له الصيغة الكيميائية NO3 -. إنه أنيون متعدد الذروة يحتوي على 4 ذرات ؛ ذرة النيتروجين واحدة وثلاث ذرات الأكسجين. أنيون لديه -1 الشحن العام. الكتلة المولية لهذا أنيون هي 62 جم/مول. أيضا ، هذا الأنيون مشتق من حمضه المترافق. حمض النيتريك أو HNO3. وبعبارة أخرى ، النترات هي قاعدة مترافق لحمض النيتريك.
باختصار ، يحتوي أيون النترات على ذرة نيتروجين واحدة في المركز ترتبط بثلاث ذرات الأكسجين عن طريق الترابط الكيميائي التساهمي. عند النظر في التركيب الكيميائي لهذا الأنيون ، فإنه يحتوي على ثلاث روابط متطابقة (وفقًا لهياكل الرنين للأنيون). وبالتالي ، فإن هندسة الجزيء هي مستوية ثلاثية. يحمل كل ذرة الأكسجين شحنة -2⁄3 ، والتي تعطي الشحن الكلي للأنيون AS -1.
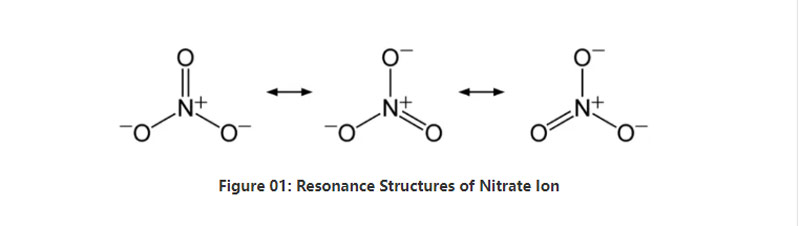
عند الضغط القياسي ودرجة الحرارة ، يذوب جميع مركبات الملح التي تحتوي على هذا الأنيون تقريبًا في الماء. يمكننا أن نجد أملاح النترات التي تحدث بشكل طبيعي على الأرض كودائع ؛ رواسب النتراتين. أنه يحتوي بشكل أساسي على نترات الصوديوم. علاوة على ذلك ، يمكن أن تنتج بكتيريا النترات أيون النترات. أحد الاستخدامات الرئيسية لأملاح النترات في إنتاج الأسمدة. علاوة على ذلك ، فهو مفيد كعامل مؤكسد في المتفجرات.
ما هو النيتريت؟
نتريت هو ملح غير عضوي له الصيغة الكيميائية NO2 -. هذا أنيون هو أنيون متماثل ، وله ذرة النيتروجين واحدة مرتبطة بذرتين من الأكسجين مع اثنين من الروابط الكيميائية غير التساهمية. وبالتالي ، فإن ذرة النيتروجين موجودة في وسط الجزيء. أنيون لديه -1 الشحن العام.
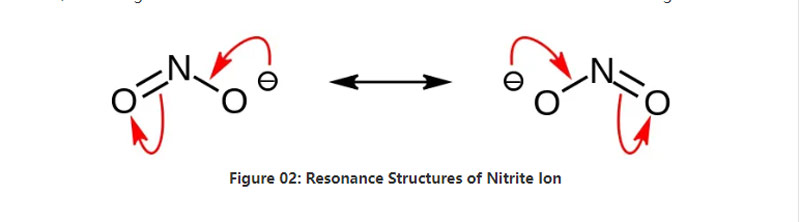
الكتلة المولية للأنيون هي 46.01 جم/مول. أيضا ، هذا الأنيون مشتق من حمض النيتروز أو HNO2. وبالتالي ، فهي قاعدة مترافق لحمض النيتروز. لذلك ، يمكننا إنتاج أملاح نتريت صناعياً من خلال تمرير أبخرة النيتروز إلى محلول هيدروكسيد الصوديوم المائي. علاوة على ذلك ، ينتج هذا نتريت الصوديوم والذي يمكننا تنقيته عبر إعادة التبلور. علاوة على ذلك ، فإن أملاح النتريت مثل نتريت الصوديوم مفيدة في الحفاظ على الطعام لأنه يمكن أن يمنع الغذاء من النمو الميكروبي.
ما هو الفرق بين النترات والنتريت؟
النترات هو أنيون غير عضوي له الصيغة الكيميائية no3 - في حين أن النيتريت هو ملح غير عضوي له الصيغة الكيميائية no2–. لذلك ، فإن الفرق الأساسي بين النترات والنتريت يكمن على التركيب الكيميائي للأنيونات. إنه؛ الفرق الرئيسي بين النترات والنتريت هو أن النترات تحتوي على ثلاث ذرات الأكسجين المرتبطة بذرة النيتروجين في حين أن النيتريت يحتوي على ذرات الأكسجين المرتبطة بذرة النيتروجين. علاوة على ذلك ، فإن أيون النترات مشتق من حمضه المترافق. حمض النيتريك ، في حين أن أيون نتريت مستمد من حمض النيتروز. كاختلاف مهم آخر بين أيونات النترات والأيونات ، يمكننا أن نقول أن النترات هو عامل مؤكسد لأنه يمكن أن يخضع للتخفيض الوحيد في حين يمكن للنتريت أن يكون بمثابة عامل مؤكسد وتقليل.
وقت النشر: مايو -16-2022





